
张 琳1,2,贠婷婷1,綦文涛1,李 杰2,李爱科1
(1.国家粮食局科学研究院,北京 100037;2.东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
摘 要:以粪肠球菌(Enterococcus faecium)为芯材,分别进行了乳化凝胶化基础上的发酵前包被和喷雾干燥基础上的发酵后包被。并以未包被的菌粉为对照,研究了两种微胶囊剂型对储藏、高温、胃液和肠液胁迫作用的抵抗能力。结果表明:常温条件下储存五个月,发酵前包被粪肠球菌的活性比菌粉组与后包被组分别提高19.46%和6.90%。110℃和130℃高温条件下,发酵前包被粪肠球菌的存活率相对发酵后包被和未包被菌粉均显著提高(P<0.05)。与未包被菌粉相比,发酵前/后包被粪肠球菌在30、90、180 min的模拟胃液处理条件下存活率均有显著提高(P<0.05),且发酵前包被优势更加明显。模拟肠液结果与模拟胃液结果类似,在处理180 min时,相对于菌粉组,发酵后和发酵前包被粪肠球菌的活性分别显著提高了14.18%和19.17%(P<0.05)。因此,微囊化粪肠球菌的抗胁迫能力要显著高于未包被菌粉,且发酵前包被要优于目前普遍流行的发酵后包被,具有更好的实际应用价值。
关键词:微囊化益生菌;发酵前包被;发酵后包被;抗胁迫;粪肠球菌
益生菌是指具有生物活性,适当的摄入量可以对宿主产生有益作用的微生物[1],益生菌制剂(Probiotics)能够定植于动物肠道内与原著菌群呈现共生、共栖、竞争及吞噬等复杂关系,通过调整微生态与酶的平衡、增强免疫力及提高胃肠内营养水平进而发挥作用,已逐步发展成为最具有应用前景的抗生素替代品。优质的饲用益生菌应该具备4个条件:在工业生产条件下,菌种保持存活;在现场与长期储存条件下保持稳定和活性;在动物的肠道内定植,有存活能力;对宿主动物产生有利的影响。通过微胶囊技术包被益生菌,可有效增强微生物对高温、胃酸及胆汁等不良环境因子的抵抗能力,提高产品的稳定性,保护菌体细胞少受剪切力的影响,进而增强益生菌的益生作用[2-3]。
目前针对微生物细胞的包被技术多为发酵后包被,即收获大量的微生物细胞,并将微生物细胞与液化的保护性壁材,如变性淀粉、明胶、乳清粉、麦芽糊精、环糊精和阿拉伯树胶等[4],进行混合,然后在高温气流中将此混合液雾化,使溶剂挥发,从而制得微囊化的益生菌产品。目前,发酵后包被法主要技术为喷雾法。发酵后包被技术存在的共性问题是,在包被过程中,微生物细胞活性会受到高温、高压及机械力等的胁迫,从而导致活性损失。微生物发酵前微胶囊制备方法,是将少量微生物细胞作为种子包被入微胶囊后,再次进行发酵,使微生物在微胶囊形成的微环境中继续增殖代谢,从而实现其高密度和高活性的目的。其产品除了具有微囊化益生菌的普遍优点之外,还具有以下几个特点:①避免了发酵后微胶囊制备过程高温、高压及机械力等的胁迫影响;②制得的微胶囊产品球形度更好,干燥后产品保持了良好分散性和球形度;③简化了产品的分离纯化过程。发酵前包被目前常用方法有:高压静电法和乳化法等[5]。
由于益生菌产品及剂型种类繁多,如何评价益生菌产品的品质是控制产品质量的关键。这其中对储藏、高温、胃酸和胆汁等体内、外胁迫的耐受力是益生菌类产品评价的关键指标[6]。目前,关于微囊化益生菌产品质量评价的报道还较少。基于此,本文以粪肠球菌为模式菌株,对其进行发酵前包被,并以发酵后包被与未包被的菌粉作为对照,研究益生菌微胶囊常见体外胁迫的耐受情况,以期为益生菌发酵前包被技术的推广使用提供理论基础。
1.1 菌种与培养基
实验菌株为粪肠球菌(Enterococcus faecium),国家粮食局科学研究院保藏菌株,培养条件:MRS培养基,37 °C耗氧培养18 h。
1.2 实验材料
海藻酸钠(CP)、碳酸钙(AR)、冰醋酸(AR)、液体石蜡(CP)、Span80(CP)、无水氯化钙(AR),均为国药集团化学试剂有限公司产品。
1.3 实验仪器
JJ-4A六联电动搅拌器,上海乔跃电子有限公司;生物倒置显微镜(CKX41型),日本Olympus公司;Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;DK-8D型电热恒温水槽,上海森信实验仪器有限公司;生物安全柜(KS18)、微生物培养箱(BD),德国Thermo。
1.4 益生菌的微囊化
益生菌发酵后包被:采用目前流行的喷雾干燥法制备,即收集对数生长末期粪肠球菌,和甘油以10∶6的比例混合,并加入0.4%的乳清粉,8%的淀粉和10%的葡萄糖混合均匀。在干燥过程中通过蠕动泵泵入麦芽糊精和明胶混合液进行包衣,微生物细胞密度为5×1010 cfu/g。
益生菌发酵前包被:参照梁新晓等方法进行[7],向海藻酸钠溶液中加入碳酸钙至浓度为10 g/L,混合均匀,灭菌后加入对数生长期的益生菌种子液,充分混匀作为水相。向液体石蜡中添加体积百分含量为0.1%的Span80,作为油相。在400~500 r/min的搅拌速度下,按照水相与油相体积比为1∶3的比例,向油相中缓慢加入水相,搅拌2~5 min,然后逐滴加入冰醋酸,反应10~15 min,向反应体系中加入CaCl2溶液,使微胶囊缓慢沉降,分离微胶囊,用清水清洗1~2次,然后将微胶囊接入发酵液中,培养至对数生长末期,过滤分离微胶囊,45℃干燥3 h,益生菌微胶囊产品的活菌数为1×1012 cfu/g。
作为对照组的菌粉同样通过45℃干燥3 h,样品的活菌数为1×1011 cfu/g。
1.5 微囊化粪肠球菌产品对常温贮藏条件的耐受性
取适量不同剂型粪肠球菌产品与未包被菌粉在常温条件下贮藏,分别在第一个月、第二个月、第三个月、第四个月与第五个月取样,每个处理三个重复,采用平板计数法计算每克产品的活菌数,判断其在常温贮藏条件下的耐受性。
1.6 高温胁迫耐受实验
在恒温干燥箱中,以未包被菌粉为对照组,对不同剂型粪肠球菌产品进行高温耐受性评价。在110℃和130℃下分别处理30、45、60 s后,采用平板计数法计算每克产品的活菌数,每个处理做三个重复。
1.7 模拟胃肠液胁迫耐受实验
模拟胃液的配制:9.5%的盐酸16.4 mL,加蒸馏水稀释,使pH值达3.0,按照每100 mL加1.0 g胃蛋白酶,混匀,0.22 μm无菌滤膜过滤,现配现用。
模拟肠液的配制:取KH2PO4 6.8 g,加入500 mL蒸馏水溶解,用4 g/L NaOH溶液调pH值至6.8,蒸馏水定容至1 L,加胆盐3%,按照100 mL加1 g胰蛋白酶,混匀,0.22 μm无菌滤膜过滤,现配现用。
分别取不同剂型益生菌产品各1 g,转移到预热的装有9 mL模拟胃液或模拟肠液试管中,37℃,80 r/min,分别处理30、90、180 min后,进行活菌计数,每个处理设三个重复[8-9]。
1.8 数据处理与分析
数据处理采用EXCEL和SPSS 17.0统计分析软件进行处理,各组间均数差异性比较采用One-Way ANOVA方法,P<0.05被认为具有显著性差异。
2.1 不同剂型粪肠球菌的储存耐受性比较
由图1可见,在常温条件下,不同剂型粪肠球菌的活性随着储存时间的延长均有降低的趋势。储存至第四月和第五月,包被粪肠球菌剂型的活性保留显著高于未包被菌粉剂型(P<0.05)。储存第五个月,粪肠球菌菌粉和发酵后包被剂型的活性分别降低至10.96%和23.52%,而发酵前包被粪肠球菌的活性为30.42%,比菌粉组与后包被组分别提高19.46%和6.90%。
在实际生产应用中,益生菌粉制剂化学稳定性和热稳定性较差,益生菌制剂的保质期也受到限制,致使产品销售与消费过程中活菌含量下降,影响其使用效果。因此,如何提高微生物细胞的储存耐受性是益生菌类产品首要解决的问题。本文常温贮藏实验结果表明,未包被的粪肠球菌活性降低十分明显,存储五个月时活性降低了90%左右,而包被后粪肠球菌的活性降低趋势相对未包被菌粉明显变缓,并且发酵前包被微胶囊剂型优于发酵后包被剂型。关于发酵前包被益生菌的储存耐受性,Kim等的研究也得出了与本文类似的结果[10]。

图1 不同剂型粪肠球菌的储存耐受性结果
注:不含相同字母表示差异显著(P<0.05)。下图同。
2.2 不同剂型粪肠球菌的高温胁迫耐受性能比较
由图2可见,未包被的粪肠球菌菌粉其活性随着温度和处理时间的增加,快速下降,至几乎完全丧失。微囊化包被后粪肠球菌的高温耐受性得到明显的改善。110℃条件下,处理30 s和45 s,发酵前和发酵后包被益生菌的存活率分别为87.60%、70.11%和77.75%、66.61%,两者耐受性无显著性差异(P>0.05);处理60 s时,发酵前包被与发酵后包被的存活率分别为43.73%和30.43%,发酵前包被显著高于发酵后包被(P<0.05)。130℃条件下,三个处理时间,发酵前包被的益生菌存活率分别为57.65%、45.08%和34.04%,发酵后包被益生菌的存活率分别为37.03%、32.69%和26.32%。发酵前包被相对于发酵后包被,表现出了显著的优势(P<0.05)。

图2 不同剂型粪肠球菌的高温耐受性结果
在添加使用于配合的颗粒饲料时,要经过高温制粒处理,而益生菌的高温耐受性非常低,尤其是乳酸菌在制粒后所存无几[11]。因此,饲用益生菌的耐热性是其性能的重要评价指标。本文结果表明,微囊化后的粪肠球菌具备了较强的耐受短时高温性能,其耐受能力相对于未包被的菌粉得到了明显的提高(P<0.05),且发酵前包被的益生菌的高温耐受性要显著优于发酵后包被。有研究表明发酵前包被的益生菌,其细胞在微胶囊内呈团块群体式增长,这不但增加了微生物细胞的密度,同时也提高了其对高温、高压等胁迫的抵抗能力,这可能也是导致其高温耐受力优于发酵后包被的主要原因[7]。
2.3 不同剂型粪肠球菌的胃液胁迫耐受性能比较
本研究使用添加胃蛋白酶制备的模拟胃液进行耐酸性能评价,结果如图3所示,与菌粉组相比,微囊化粪肠球菌在模拟胃液处理不同时间条件下,存活率都有显著提高(P<0.05)。未包被的菌粉在模拟胃液处理30、90、180 min后,活性分别降低了61.17%、66.25%和72.00%。发酵后包被粪肠球菌的活性分别降低了19.38%、24.04%和30.47%。而发酵前包被活性则分别降低了9.37%、14.04%和25.27%。发酵前包被粪肠球菌的存活率要高于发酵后包被,但差异并不显著(P>0.05)。
人体及动物胃部的低pH以及多种酶类对益生菌具有潜在的灭活作用。益生菌进入消化道后对其耐受力低,难以有足够数量的活菌到达肠道定植,影响了益生菌作用的发挥。本实验结果提示,微囊化后粪肠球菌对胃环境的耐受力得到了明显的提高,且发酵前包被具有更好的胃环境耐受潜力。益生菌发酵前包被的其他相关研究也给出了类似的结果,如微囊化处理能提高嗜酸乳杆菌菌株对酸、胃蛋白酶、胆盐、胰蛋白酶和高渗透压等条件的抵抗力,保证其生理功能的发挥[12]。也有研究证实,未经微囊化的双歧杆菌在人工胃液处理30 min后基本失活,而经过发酵前包被后的双歧杆菌,经过人工胃液处理2 h后,存活率仍然显著(P<0.05)[13]。Yokota等采用喷雾冷却法加工双歧杆菌微胶囊,得到粒径为40~60 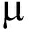 m的胶囊,产品在胃液中存活率显著提高[14]。李秋琴等研究微囊化植物乳杆菌经过人工胃液处理后,微胶囊化植物乳杆菌的存活率显著高于未微胶囊化的[15]。综上,微囊化后的益生菌对胃液的耐受能力明显提高,并且本实验结果显示发酵前包被益生菌具有更好的耐受性。
m的胶囊,产品在胃液中存活率显著提高[14]。李秋琴等研究微囊化植物乳杆菌经过人工胃液处理后,微胶囊化植物乳杆菌的存活率显著高于未微胶囊化的[15]。综上,微囊化后的益生菌对胃液的耐受能力明显提高,并且本实验结果显示发酵前包被益生菌具有更好的耐受性。

图3 不同剂型粪肠球菌的模拟胃液耐受性结果
2.4 不同剂型粪肠球菌的肠液胁迫耐受性能比较
图4为不同剂型粪肠球菌的模拟肠液耐受性结果,由图可见,类似于模拟胃液中的结果,随着处理时间的延长,不同处理组的粪肠球菌活性都有所下降,且未包被的粪肠球菌的存活率下降程度显著高于(P<0.05)微囊化粪肠球菌。处理180 min时,粪肠球菌菌粉的活性降低了48.62%,而发酵前/后包被剂型的活性则分别降低了29.45%与34.44%。

图4 不同剂型粪肠球菌的模拟肠液耐受性结果
肠道部位的较高渗透压会使以外源微生物为主的益生菌产生质壁分离,导致其死亡,因此益生菌对胆盐的抗性是其能够在肠道内存活、生长的先决条件之一。评价饲用益生菌的肠道耐受性,一般选用0.15%~0.3%的禽胆盐或者猪胆盐[16],本研究采用0.3%胆盐含量的模拟肠液进行了益生菌肠液耐受性实验[17]。结果表明,微囊化后粪肠球菌对肠道高盐环境的耐受力得到了明显的提高,且发酵前包被再次表现出了更好的效果。Pimentel-Gonzalez等[18]研究发现,采用乳化法对鼠李糖乳杆菌进行包被,结果显示微囊化乳酸菌的抗胆盐能力明显增强,与本实验结果类似。
微胶囊化技术已被证明是维持益生菌高存活率和高稳定性的最好方法之一,在开发新的微胶囊化技术的同时,微囊化益生菌大规模工业生产也在逐步实现,其中乳化法与喷雾干燥法用到工业领域的可能性最大,所以本文通过乳化凝胶化法对粪肠球菌进行发酵前包被,喷雾干燥法对粪肠球菌进行发酵后包被,以未包被的粪肠球菌菌粉为对照进行了抗胁迫性能的研究。结果表明微囊化显著提高了储藏过程中和胃肠液环境下粪肠球菌的存活率,显著增强了粪肠球菌对高温环境的耐受性,且发酵前包被粪肠球菌的抗胁迫能力要优于发酵后包被剂型,表现出了更好的应用潜力。
参考文献:
[1]Madchett D.Report on joint FAO/WHO expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R].Cordoba:American Cordoba Park Hotel,2001:903-920.
[2]徐致远,郭本恒,陈卫.乳酸菌微胶囊技术的研究进展[J].乳业科学与技术,2005,114(5):198-201.
[3]曹永梅.肠溶性双歧杆菌微胶囊的制备[J].食品与发酵工业,2000,25(2):71-77.
[4]Heidebach T,Forst P,Kulozik U.Microencapsulation of probiotic cells for food applications[J].Crit Rev Food Sci,2012,52(4):291-311.
[5]罗佳琦.嗜酸乳杆菌微胶囊化制备方法的研究[D].辽宁:大连理工大学,2009.
[6]张璐,张敏红.饲用益生菌产品评价研究进展[J].中国畜牧兽医,2008,38(3):21-24.
[7]梁新晓,贠婷婷,田科雄,等.内源乳化凝胶化法制备海藻酸钙微胶珠的工艺优化[J].食品科学,2014,35(12):35-40.
[8]Fernandez M F,Boris S,Barbes C,et al.Probiotic properties of human lactobacilli strains to be used in the gastrointestinal tract[J].J Appl Microbiol,2003,24(9):449-455.
[9]De A M,Siragusa S,Berloco M,et al.Selection of potential probiotic lactobacilli from pig fece to be used as additives in pelleted feeding[J].Res Microbiol,2006,157(8):792-801.
[10]Kim S J.,Cho S Y.,Kim S H,et al.Effect of microencapsulation on viability and other characteristics in Lactobacillus acidophilus ATCC 43121[J].LWT-Food Sci Technol,2008,41(3):493-500.
[11]郝生宏,董晓芳,佟建明,等.不同饲料制粒条件和保存时间对益生菌活力的影响[J].中国畜牧杂志,2009,1(45):51-53.
[12]夏枫耿,黄晓曼.微囊化双歧杆菌的研究[J].中国食品添加剂.2002,6:25-28.
[13]Chuang H S,Kim Y B,Chun S L,et al.Screening and selection of acid and bile resistant bifidobacteria[J].Int J Food Microbiol,1999,47(1):25-32.
[14]Yokota T,Sato T,Uemitsu N,et al.Lactobacillus tablet provided with enteric coating[P].Japanese Application Publication,JP 04-41434 1992.
[15]李秋琴,陆淳,朱宏,等.植物乳杆菌的微胶囊化及其质量评价[J].食品科技.2013,5(38):10-13.
[16]邓露芳,王加启,卜登攀,等.饲用微生物评价研究进展[J].中国农学通报,2009,25(23):7-12.
[17]张晓琳,韩伟,陶浩瀚,等.微囊化屎肠球菌微生态制剂的研究[J].山东畜牧兽医,2010(增刊):36-42.
[18]Pimentel-Gonzalez D J,Campos-Montiel R G,Lobato-Calleros C,et al.Encapsulation of Lactobacillus rhamnosus in double emulsions formulated with sweet whey as emulsifier and survival in simulated gastrointestinal conditions[J].Food Res Int,2009,42:292-229.![]()
ZHANG Lin1,2,YUN Ting-ting1, QI Wen-tao1, LI Jie1,2, LI Ai-ke1
(1.Academy of State Administration of Grain, Beijing, 100037; 2.College of Animal Science and Technology, Northeast Agricultural University, Harbin Heilongjian 150030)
Abstract:The enterococcus faecium were pre-fermented encapsulated by the method of emulsionand internal gelation and post-fermented encapsulated by spraying dry.The stress resistance of the both microencapsulation formulations to the storage, high temperature, gastric juice and intestinal juice were evaluated compared with free enterococcus faecium.The results showed that the survival rates of pre-fermented encapsulated enterococcus faecium were 19.46%and 6.90%higher respectively than those of un-capsulated and post-fermented encapsulated enterococcus faecium after storage at room temperature for five months.The resistance of enterococcus faecium to the high temperature at 110℃ and 130℃ was significantly increased(P<0.05) by the pre- fermented encapsulation compared with post-fermented encapsulation and free.The survival rates of pre- fermented encapsulated and post-fermented encapsulated enterococcus faecium were significantly increased(P<0.05) compared with those of uncoated ones when they were treated in the simulated gastric conditions for 30, 90 and 180 min.The pre-fermented encapsulated was particularly evident.The results were similar in mimic environments of gastric juice and intestinal juice.The survival rates of pre-fermented encapsulated and post-fermented encapsulated enterococcus faecium were increased 19.17%and 14.18%(P<0.05)compared with un-capsulated ones after they were treated in the simulated intestinal conditions for 180 min.These results suggest that the resistance of encapsulated enterococcus faecium is much higher than that of un-capsulated ones.The pre- fermented encapsulation can be an effective way than post-fermented encapsulation for protecting probiotic microbes and has a high value of practical application.
Key words:microencapsulated probiotics; pre-fermented encapsulated; post-fermented encapsulated; stress resistance; enterococcus faecalis
收稿日期:2015-09-02
基金项目:“十二五”农村领域国家科技计划课题(2013BAD10B02);动物营养学国家重点实验室2013年度开放课题(2004DA125184F1306);北京市现代农业产业技术体系家禽创新团队资金(CARS-PSTP)
作者简介:张琳,1988年出生,女,博士研究生.
通信作者:綦文涛,1977年出生,副研究员.
中图分类号:TQ 920.6
文献标识码:A
文章编号:1007-7561(2016)02-0000-00