近红外光谱应用于高粱中总淀粉、直链淀粉与支链淀粉的定量分析
邵春甫1,2,李长文2,3,王 珊2,王 凡2,尤 伟2,孙国娟2,邹江鹏3,周欣乐3
(1.天津科技大学 生物工程学院,天津 300457;2.天士力控股集团有限公司研究院,天津 300410;3.贵州国台酒业有限公司,贵州 仁怀 564501)
摘 要:酱香型白酒以高粱为主要原料发酵而成,高粱中的淀粉,尤其是支链淀粉的含量对于酱香型白酒的产品质量起着至关重要的作用,因此针对其总淀粉、直链淀粉与支链淀粉的检测手段研究也应受到人们高度的重视。傅里叶变换近红外光谱法因其准确性高、稳定性好以及快速无损检测等特点,在建立总淀粉、直链淀粉和支链淀粉同时定量分析模型方面得到了较为成功的应用。结果表明,总淀粉、直链淀粉以及支链淀粉的定量分析模型相关系数分别达到0.954 9、0.923 6和0.940 1,交互验证均方根误差分别为1.027 1、0.088 5和1.264 6。可见,基于近红外光谱技术的定量分析方法可适用于高粱中总淀粉、直链淀粉与支链淀粉的同时定量分析。
关键词:直链淀粉;支链淀粉;傅里叶变换近红外光谱;定量分析
酱香型白酒的基酒是以糯高粱为原料,用小麦制曲发酵而成。在酱香型白酒的品质保证体系中,对原料质量的控制是很重要的一环。原料品质的优劣,对发酵质量起着决定性的作用,进而对成品酒质量产生重大影响[1]。
目前多数酱香型白酒的生产厂家对高粱的品质并没有成熟的评价体系,高粱经润沙、蒸煮、摊凉等前处理步骤之后,即加曲收堆发酵,未实现从源头对产品质量进行把关。
高粱发酵酿酒的机理主要为淀粉原料先行水解,而后水解所得糖类经由酵母菌分解发酵产生酒精:
(C6H10O5)n+nH2O = nC6H12O6
C6H12O6 = 2CH3CH2OH+2CO2↑
酱香型白酒的发酵工艺持续时间长达一年,须经八次发酵,七次取酒,九次蒸煮,故而对发酵原料的淀粉含量要求较高,这也就是选用当地特产糯高粱作为酱香型白酒发酵原料主因[2]。若所用糯高粱中淀粉,尤其是支链淀粉含量偏低,或杂质含量偏高,就会对全年八次发酵的结果造成不良影响,故而寻求一种准确测定高粱籽粒中总淀粉以及直链淀粉、支链淀粉含量的科学分析手段对保证酱香型白酒的产品质量至关重要。
目前在检测高粱糥性方面虽有较为成熟的人工方法,但该方法仍然存在主观性、重现性差、检测速度慢、误差较大的缺陷。故而酱香型白酒生产企业急需一种针对支链淀粉含量以及高粱糥性的快速、准确的检验方法,并在此基础上建立适用于生产实际的高粱品质检验标准。
傅里叶变换近红外光谱法(FT-NIRS),相对于紫外—可见分光光度法以及高效液相色谱法,具备其自身特有的优势。近红外光谱分析具有样品用量少、预处理简单、分析速度快、无损整体检测等优势,已得到广泛的应用。近红外光谱可用于定量分析,虽然准确度和精密度较色谱法略低,但红外光谱具有多样性,可根据被测物质的性质灵活应用,固态、液态乃至于气态样品皆可直接进样。最重要的一点是红外光谱的定量分析可以通过直接测定混合物的红外光谱、通过计算机算法处理谱图来建立预测模型,大大简化了对样品进行繁琐的前处理,节约了时间和成本,实现快速、准确检测[3]。近红外光谱技术在近几年来也引入到酿酒产业中,作为成品酒质量重要的检测手段,在黄酒[4-5]和白酒[6-7]生产中均得到了成功的应用。
1 材料与方法
1.1 仪器与试剂
Spectrum 400傅里叶变换红外光谱仪:美国Perkin-Elmer公司;U-3010紫外可见分光光度计:日本日立公司;WZZ-2S旋光仪:中国上海精密科学仪器有限公司。
直链淀粉、支链淀粉标准品:自美国Sigma公司;其他试剂均为分析纯。
直链淀粉标准溶液配制 称取0.1000 g直链淀粉标准品于100 mL容量瓶中,加入1 mL无水乙醇、9 mL 1 mol/L 氢氧化钠溶液,80 °C水中分散10 min,冷却后定容。
支链淀粉标准溶液配制:同直链淀粉。
碘试剂配制:称取0.2 g碘于100 mL容量瓶中,加少量水溶解后加入2.0 g碘化钾,定容至刻度。
1.2 样品及预处理
全部63个高粱样品由贵州国台酒业有限公司提供,产地包括贵州、河北、天津、辽宁、山西以及甘肃等6个省市。高粱样品经粉碎、过100目筛后用于实验分析以及谱图采集。
1.3 高粱中的总淀粉、直链淀粉与支链淀粉测定
1.3.1 总淀粉
先测定高粱样品的水分含量,再用国标GB/T 5006—1985[8-9]改进的旋光比色法测定高粱中的总淀粉。
称取粉碎过筛的高粱样品2.5 g,加入60 mL CaCl2-HAc分散液(pH = 2.30±0.05),油浴加热至120±1℃恒温25 min后冷却至室温,加入1 mL 30%硫酸锌溶液以及1 mL 15%亚铁氰化钾溶液沉降蛋白。混合体系经过滤后,以CaCl2-HAc分散液为对照测定其旋光度。总淀粉含量(干基)按照以下公式计算:
总淀粉含量/%=A×106/[LW(100-H)×203]
式中:A为旋光度;L为旋光管长度,dm;W为样品质量,g;H为样品水分含量,%。
1.3.2 直链淀粉与支链淀粉
按国标GB 7648—1987[10]改进的紫外可见分光光度法测定高粱中直链淀粉与支链淀粉含量。
分别量取1 mg/mL直链淀粉标准溶液3.0、2.5、2.0、1.5、1.0以及0 mL于100 mL容量瓶中,加入2.0、2.5、3.0、3.5、4.0以及5.0 mL支链淀粉标准溶液,分别使用0.1 mol/L盐酸调节pH至3.5,加入碘试剂0.5 mL,定容,得直链淀粉梯度浓度溶液。
分别扫描各标准梯度溶液的全波长紫外光谱图(1 100 ~900 nm),确定支链淀粉的双波长分析波长为726 nm和584 nm,在此基础上建立支链淀粉分析标准曲线。
以总淀粉含量减去支链淀粉含量可得直链淀粉含量。
1.4 近红外光谱采集
谱图采集使用积分球附件,扫描中谱图累积扫描128次,扫描速率0.2 cm/s,谱图分辨率2 cm-1。
1.5 定量分析
应用所采集的近红外谱图与紫外-可见分光光度数据分别建立高粱籽粒中总淀粉、直链淀粉与支链淀粉的偏最小二乘(Partial Least Squares,PLS)定量分析模型[11],谱图预处理采用基线校正(Baseline Correction,BC)以及多元散射校正(Multiple Scatter Correction,MSC)[12],用模型的相关系数(Correlation Coefficient,R)与预测均方根误差(root mean squared errors of prediction,RMSEP)来评价模型预测能力。以相关系数(R)达到0.9000以上作为定量分析模型达到实用标准的判断依据。
2 结果与分析
2.1 旋光分析以及紫外—可见分光光度法结果
经旋光比色法测得的样品总淀粉含量和经紫外—可见分光光度法测得的支链淀粉含量结果如见表1。
表1 各组分测定结果 %

样品编号总淀粉含量支链淀粉直链淀粉样品编号总淀粉含量支链淀粉直链淀粉167.4365.891.543362.0460.4791.56265.9064.151.753462.6161.1241.49364.9563.241.713557.2855.8891.39465.4063.242.173659.1457.6791.46562.9761.171.803755.8954.5961.29663.1961.321.873863.0961.5311.56763.4461.761.683967.7966.211.58864.9363.421.514061.8660.521.34960.5159.021.494162.5761.590.981062.5961.031.564262.6861.461.221164.7263.351.374362.5561.201.341262.0660.841.224457.8656.731.121364.4263.071.344562.2360.821.411465.1863.691.494663.3862.251.121566.0064.461.544757.6756.501.171664.7463.431.324862.9961.691.291760.7859.561.224957.9456.581.371865.0263.801.225061.1859.771.421966.0364.691.345159.7358.201.542066.3465.001.345257.6956.421.272163.1761.931.255364.3062.761.542265.7364.101.635461.0959.551.542351.4549.891.565560.0458.361.682462.7060.951.755663.1361.142.002553.2351.431.805753.0651.381.6812663.7661.891.875858.7756.871.902759.9258.221.715958.9856.942.042857.0755.561.516054.1852.311.872959.6758.011.656158.8156.941.873058.7657.301.466257.4056.520.883160.4759.011.466357.5756.710.863268.9867.301.68平均值61.5460.041.50标准差3.7443.7380.269
2.2 傅里叶变换近红外光谱法建模定量分析结果
在建模定量分析的过程中,基线校正(Baseline Correction,BC),多元散射校正(Multiplicative Scatter Correction,MSC)以及归一化(Normalization)三种方法作为谱图预处理方法用以改善建模分析效果(图1)。
从表2中可出,定量分析模型相关系数R值在三种预处理方法同时处理时达到最大值。
a 基线校正谱图;b 多元散射校正谱图;c 归一化谱图
图1 傅里叶变换近红外谱图
表2 模型定量分析结果
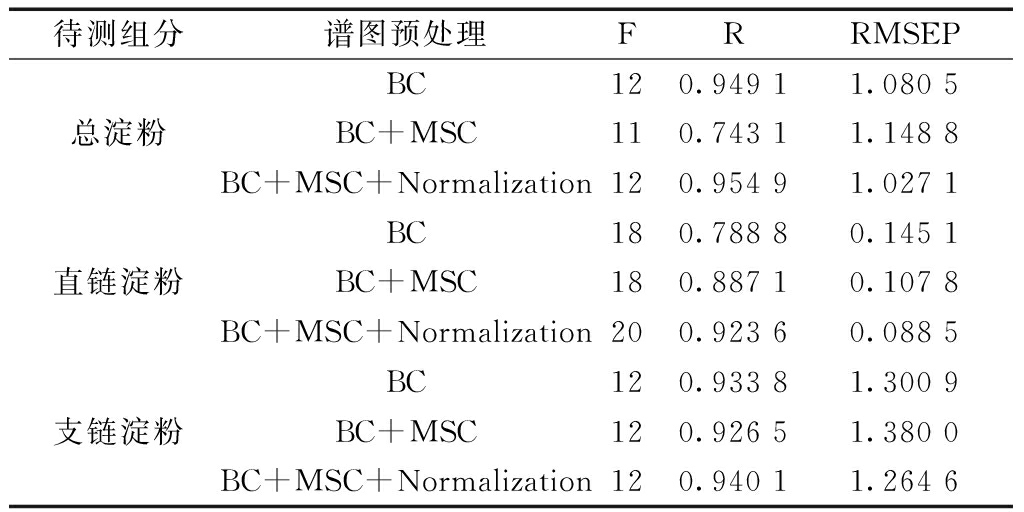
待测组分谱图预处理FRRMSEP总淀粉BC120.94911.0805BC+MSC110.74311.1488BC+MSC+Normalization120.95491.0271直链淀粉BC180.78880.1451BC+MSC180.88710.1078BC+MSC+Normalization200.92360.0885支链淀粉BC120.93381.3009BC+MSC120.92651.3800BC+MSC+Normalization120.94011.2646
注:F为建模主成分数;R为相关系数;RMSEP为预测均方根误差。
总淀粉、直链淀粉与支链淀粉的定量分析模型见图2。
图2 总淀粉(a)、直链淀粉(b)与支链淀粉(c)的定量分析模型
运用傅里叶变换近红外光谱法测定全部63个样品的总淀粉、直链淀粉以及支链淀粉的含量,结果见表3。
从分析结果看,FT-NIRS模型测定的结果与旋光法、紫外—可见分光光度法的结果符合度较好,说明使用FT-NIRS测定高粱中总淀粉、直链淀粉与支链淀粉含量是可行的。FT-NIRS具有检测速度快、重现性好等优势,单个样品检测时间在5 min之内,且操作简便,大大降低了样品检测成本,提高了工作效率。
3 结束语
应用63个样本点所采集的近红外谱图与紫外—可见分光光度数据分别建立高粱中总淀粉、直链淀粉与支链淀粉的偏最小二乘(PLS)定量分析模型。在建模定量分析的过程中,利用基线校正(BC),多元散射校正(MSC)以及归一化(Normalization)三种方法修整模型,提高模型的精度,总淀粉、直链淀粉以及支链淀粉分析模型的相关系数R分别达到0.954 9、0.923 6以及0.940 1,交互验证均方根误差(RMSEP)分别为1.027 1、0.088 5和1.264 6。本实验建立的近红外光谱分析技术对酿酒过程中高粱总淀粉、直链淀粉、支链淀粉的快速、无损检测具有很大的实用价值。
表3 近红外定量分析模型预测总淀粉、直链淀粉与支链淀粉结果

样品编号总淀粉含量支链淀粉直链淀粉样品编号总淀粉含量支链淀粉直链淀粉168.4467.081.553360.6857.461.69267.9366.221.923461.1859.961.50367.18964.171.913556.2751.241.23467.5963.692.143658.6654.441.36562.6560.451.943754.9951.131.14664.9460.591.963863.4561.081.71765.5762.311.793960.1566.981.74866.6464.481.514061.7558.041.21959.5756.171.424161.0561.180.911061.1659.371.664261.7560.711.111166.1164.271.224361.0560.511.221260.7258.631.014456.7652.600.971366.0363.551.164560.9358.241.291467.5365.281.474665.3963.030.981567.9466.341.574756.4151.760.991666.4864.871.154863.0361.531.141759.7156.471.054956.9552.261.231867.2965.631.105060.1057.451.251967.9466.601.165158.9454.881.572068.2266.731.185256.4951.681.132164.6562.941.135365.7563.301.592267.7066.221.755459.9156.431.652352.2450.271.685559.0855.311.902462.6258.801.935663.9160.402.052552.8550.561.945752.3350.301.822665.6762.392.015857.1952.702.042759.0455.011.925958.4654.182.142855.7251.241.516053.4950.772.0352958.7154.691.786158.3253.862.043057.1254.261.326256.3052.250.893159.3956.021.346356.3252.360.893268.8067.031.81平均值61.5858.741.50标准差4.6995.3890.373
参考文献:
[1]熊子书.酱香型白酒酿造[M].北京:中国轻工业出版社,1994.
[2]丁国祥,李天炬,曾庆曦.糯高粱籽粒淀粉含量及其组份的配合力分析[J].西南农业大学学报.1999,21(2):153.
[3]LI J,ZHANG Y,CAI W,SHAO X.Simultaneous determination of mercury,lead and cadmium ions in water using near-infrared spectroscopy with preconcentration by thiol-functionalized magnesium phyllosilicate clay..Talanta,2011,84:679-683.
[4]SHEN F,NIU X,YANG D,YING Y,LI B,ZHU G and WU J.Determination of amino acids in chinese rice wine by fourier transform near-infrared spectroscopy.J.Agric.Food Chem,2010,58:9809-9816.[5]YU H,LIN H,XU H,YING Y,LI B and PAN X.Prediction of enological parameters and discrimination of rice wine age using least-squares support vector machines and near infrared spectroscopy.J.Agric.Food Chem,2008,56:307-313.
[6]李长文,魏纪平,孙素琴,等.运用红外光谱技术鉴别酱香型白酒[J].酿酒科技.2006,11(149):56-58.
[7]张玲,于健.基于偏最小二乘(PLS)法白酒中乙醇含量的近红外检测[J].食品工业.2006(4):27-29.
[8]GB/T 5006—1985,谷物籽粒粗淀粉测定法[S].
[9]范明顺,张崇玉,张琴,李晓飞.双波长分光光度法测定高粱中的直链淀粉和支链淀粉[J].中国酿造.2008,21(198):85-87.
[10]GB7 648—1987,水稻、玉米、谷子籽粒直链淀粉测定法[S].
[11]谭超,吴同,覃鑫.偏最小二乘组合后向区间选择在近红外定量建模中的应用[J].计算机与应用化学.2008,25(4):509-512.
[12]李彦周,闵耕顺,刘霞.主成分分析在近红外定量分析校正集样本优选中的应用[J].分析化学.2007,35(9):1334-1334.
Quantitative analysis of starch, amylose and amylopectin in sorghum seeds by Fourier transform near infrared spectroscopy
SHAO Chun-fu1,2,LI Chang-wen2,3,WANG Shan2,WANG Fan2,YOU Wei2, SUN Guo-juan2,ZOU Jiang-peng3,ZHOU Xin-yue3
(1.College of Biological Engineering, Tianjin University of Science and Technology, Tianjin 300457; 2.Tasly Academy, Tianjin 300410;3.Guizhou Guotai Liquor Co.Ltd., Renhuai, Guizhou 564501)
Abstract:The content of starch, especially amylopectin, in sorghum seeds are extremely important to the quality of Moutai-flavor liquor which was fermented from sorghum, yet the research on determination for starch, amylose and amylopectin is paid great attention.Fourier transformed near infrared spectroscopy(FT-NIRS), due to its accuracy, stability, quickness and non-destructiveness, was successfully applied to setup a simultaneous determination system of starch, amylose and amylopectin.The results showed that the correlation coefficients of starch, amylose and amylopectin quantitative models were 0.954 9、0.923 6 and 0.940 1, while the root mean square errors of cross validation were 1.027 1、0.088 5 and 1.264 6.Thus it was concluded that FT-NIR is absolutely appropriate for the analysis job.
Key words:amylose; amylopectin; Fourier transform near infrared spectroscopy(FT-NIR Spectroscopy); quantitative analysis
收稿日期:2015-07-29
基金项目:贵州省工业攻关项目(黔科合GY字[2014]3031)
作者简介:邵春甫,1984年出生,男,工程师,博士研究生.
中图分类号:TS 207.3
文献标识码:A
文章编号:1007-7561(2016)02-0060-05








