方佩佩,王世清,李 静,谭海刚,刘晓莉,付均鹏
(青岛农业大学 食品科学与工程学院,山东 青岛 266100)
摘 要:采用紫外诱变法进行酿酒酵母的诱变,选育发酵速度较快、产酒精能力较强的酿酒酵母工业菌株。以致死率和正突变率为主要指标,以突变株的酒精发酵性能为参考,结合单因素实验和正交实验,确定出紫外诱变法的较佳诱变条件为:辐照功率20 W,紫外灯辐照时间10 min,辐照距离9 cm。以出发菌株F1为对照,对7株酵母突变株进一步进行全面的生理性能测试,结果表明,菌株F4的CO2失重量最高、残糖含量低、乙醇和酯类物质的产生量高,是一株优良的正向突变株。对该菌株进行形态观察,其细胞个体饱满呈卵圆型,群体菌落颜色呈乳白色;用于紫甘薯汁发酵,起酵速度快、发酵液酒精度可达11.08%(V/V),香气浓郁,具有良好的工业生产潜力。
关键词:紫外诱变;酵母菌;育种;紫甘薯
酵母菌,一般泛指能发酵糖类的各种单细胞真菌[1]。酵母菌一般以单细胞状态存在,多数出芽繁殖,少数裂殖。酵母菌的种类很多,据Kreger Van Rij的资料,当时已知的酵母有56属,500多种,与人类关系极为密切[2],是人类实践中应用较早的一类微生物,同时也是现代发酵工业的重要微生物[3-4]。
酵母菌能够将环境中的糖发酵分解为二氧化碳和乙醇,人们利用酵母菌能够发酵产生酒精的特点将其应用到酿酒工业中,这在中国已经有4000多年的历史[1-2]。但是传统的酵母菌在发酵酿酒过程中存在一定的局限性:一是酵母菌的生长、发酵受酒精浓度的限制,当发酵产酒精到一定程度后受酒精浓度的限制生长缓慢,增加了生产的经济成本;二是酵母菌在利用底物的过程中能够发酵产生酯类物质,但是产生的酯类物质的质量和种类却有一定的局限,这会直接影响酒的味道和口感等[3-4]。
优良的微生物菌种是发酵工业的基础和关键,要使发酵工业产品的种类、产量和质量有较大的改善,首先必须选育性能优良的生产菌株,传统的从自然界中分离、纯化的酿酒酵母,其综合性能难以有较大提高。通过一定的物理、化学方式对酿酒酵母进行诱变,可以从基因层面上改变酵母菌的性质,这对选育综合性能较高的酵母菌株具有重要意义[5-9]。
紫外诱变效应主要是指紫外照射引起菌株DNA结构的改变,使DNA分子相邻嘧啶之间双键打开形成嘧啶二聚体,包括产生环丁烷结构和6-4光产物,并使DNA产生弯曲和扭结等[2],阻碍DNA的复制或引起碱基排列次序的变化,从而引起基因突变[10]。在进行紫外线处理时要在红光下或者黑暗中进行照射及处理,以避免光复活作用的发生。紫外线(UV)的能量低,对核酸造成的伤害比较单一[1],操作简便、效率高、安全性好,并且UV的诱变效率高,在避光条件下诱变结束后已产生突变的性状不易恢复,因此应用较广泛[11-12]。
本文采用紫外法对酿酒酵母进行单次诱变处理,研究了紫外诱变酿酒酵母的最佳条件,采用富含硒和花青素等营养成分的紫甘薯作为发酵原料,对诱变菌株进行筛选,得到一株发酵能力和产酯能力较强的优良酵母菌株。
1.1 材料与设备
1.1.1 材料及主要试剂
酿酒酵母:青岛农业大学微生物试验室保存的酵母F1;紫甘薯:青岛市城阳区春阳路大润发超市购买;蛋白胨:天津市巴斯夫化工有限公司;牛肉膏、酵母膏、琼脂粉:天津市博迪化工有限公司;α-淀粉酶、糖化酶:青岛生物技术有限责任公司;其他试剂均为国产分析纯。
1.1.2 主要设备
光学显微镜购自Leica BME;电热水浴锅购自龙口先科仪器公司;UV-1200型紫外可见分光光度计购自上海美谱达仪器有限公司;电子天平购自DENVER INSTRUMENT;手持式折光仪购自北京鹏程光学仪器有限公司;紫外诱变台(15 W紫外灯)购自苏州净化设备有限公司;SBA-40E生物传感分析仪购自山东省农科院。
1.1.3 培养基
培养基:YPD 培养基;PDA培养基;麦芽汁培养基。
紫甘薯糖化液发酵培养基[13]:清洗→蒸煮(蒸煮时间为100 min、蒸煮温度为100 ℃)→去皮→加水打浆(紫甘薯质量与水体积比为1∶1.5)→液化(加α-高温淀粉:调节pH至6.0,水浴温度95 ℃,添加量0.1%,液化时间为40 min)→糖化(糖化酶:调节pH至4.5,水浴温度65 ℃,添加量0.1%,液化时间为60 min)→过滤→调酸度、糖度→紫甘薯糖化液发酵培养基。
1.2 实验方法
1.2.1 酵母活化、初筛
将冷藏的酵母菌接种于YPD液体培养基上,28 ℃培养12 h,涂布平板,30 ℃培养24 h,挑取长势良好、菌落大、乳白色馒头状的单菌落作为初选菌,保存到YPD固体培养基斜面上,30 ℃培养24 h,得活化的诱变出发菌株。
1.2.2 酵母菌生长曲线的测定
将活化的酵母菌按5%接种量接种至YPD液体培养基,30 ℃培养,每隔2 h取样,600 nm测吸光值,以空白的YPD培养液为对照,根据所测得的吸光值做出酵母的生长曲线[11]。
1.2.3 紫外线(UV)对酵母菌的处理
将活化后的酵母菌制成菌悬液,取5 mL到培养皿中,至于紫外灯下进行处理,并设置不做处理的对照组。每个经紫外处理后的菌悬液涂布3个PDA平板,28 ℃避光培养48 h,防止光复活,平板计数,并随机选取诱变后的酵母菌斜面保藏,进行发酵实验,测量诱变前后菌株发酵后产物中酒精产量及总酯含量,酒精含量及总酯含量同时变高的菌株即为正突变菌株,计算致死率、正突变率。
1.2.4 CO2失重法测发酵性能
发酵力是判断发酵性能的指标[12]。酵母在同化利用可发酵糖的过程中产生乙醇和CO2,发酵液重量会随着CO2的逸出而减少。在150 mL三角瓶中装入80 mL紫甘薯液,灭菌后接种待测酵母菌,25 ℃发酵,每隔8 h称重,绘制CO2的产量变化曲线。
1.2.5 发酵液残糖量的测定
调整起始发酵液的糖度为22波美度,手持式折光仪法测量发酵后发酵液的糖度,分析发酵性能。
1.2.6 发酵后乙醇产量的测定
利用生物传感分析仪中的乙醇酶膜测量发酵液中乙醇含量,标准液是1.25%乙醇水溶液。
1.2.7 发酵产酯能力的测定
参照GB/T 10345—2007,回流皂化法测酯含量。
1.2.8 计算
1.2.8.1 致死率的计算
按以下公式计算致死率:
![]() ×100%,式中:Z-致死率(%),X-紫外线处理后的菌落数(个),X1-紫外线处理前的菌落数(个)。
×100%,式中:Z-致死率(%),X-紫外线处理后的菌落数(个),X1-紫外线处理前的菌落数(个)。
1.2.8.2 正突变率的计算
按以下公式计算正突变率:
![]() ,式中:f-致死率(%),T-正突变酵母菌株个数(个),T1-测定的酵母菌株个数(个)。
,式中:f-致死率(%),T-正突变酵母菌株个数(个),T1-测定的酵母菌株个数(个)。
1.2.8.3 糖醇转化率的计算
按以下公式计算糖醇转化率:
式中:s为糖醇转化率,C为成熟醪酒精体积百分浓度(%,V/V),G为糖化醪外观糖度(Brix)。
2.1 生长曲线的测定
测定酵母不同时间的吸光值(600 nm),绘成生长曲线,如图1所示。

图1 酿酒酵母菌的生长曲线
如图1所示,8 h到16 h之间酵母菌处于对数生长期,生长繁殖旺盛。对数生长期是基因复制和重组的重要阶段,在此阶段对酵母菌进行紫外辐照,可以增加基因突变、稳定遗传的几率,因此选择活化8~16 h的酵母菌进行诱变。
2.2 紫外诱变条件的确定
2.2.1 诱变辐照功率对诱变效果的影响
将配置好的菌悬液溶液分别置于10、15、20、25、30 W的紫外灯下照射,辐照时间8 min,辐照距离9 cm,辐照后进行平板涂布和发酵培养,计算致死率和正突变率,结果见图2。
如图2所示,不同UV辐照功率下的酵母菌致死率曲线为典型的马鞍型曲线[15]。随紫外强度的增大,酵母菌致死率先增大后减小再增大,直至致死率达到100%,正突变率呈先增大后减小的趋势。一般情况下产生正突变体的点都在致死率曲线的极小值处(即修复机制被激发的点),修复机制对正突变体的产生起着至关重要的作用[14]。酵母菌致死率在紫外强度20 W时达到极小值,且在此处正突变率达到最大值,因此初步选择20 W作为紫外诱变的辐照功率。
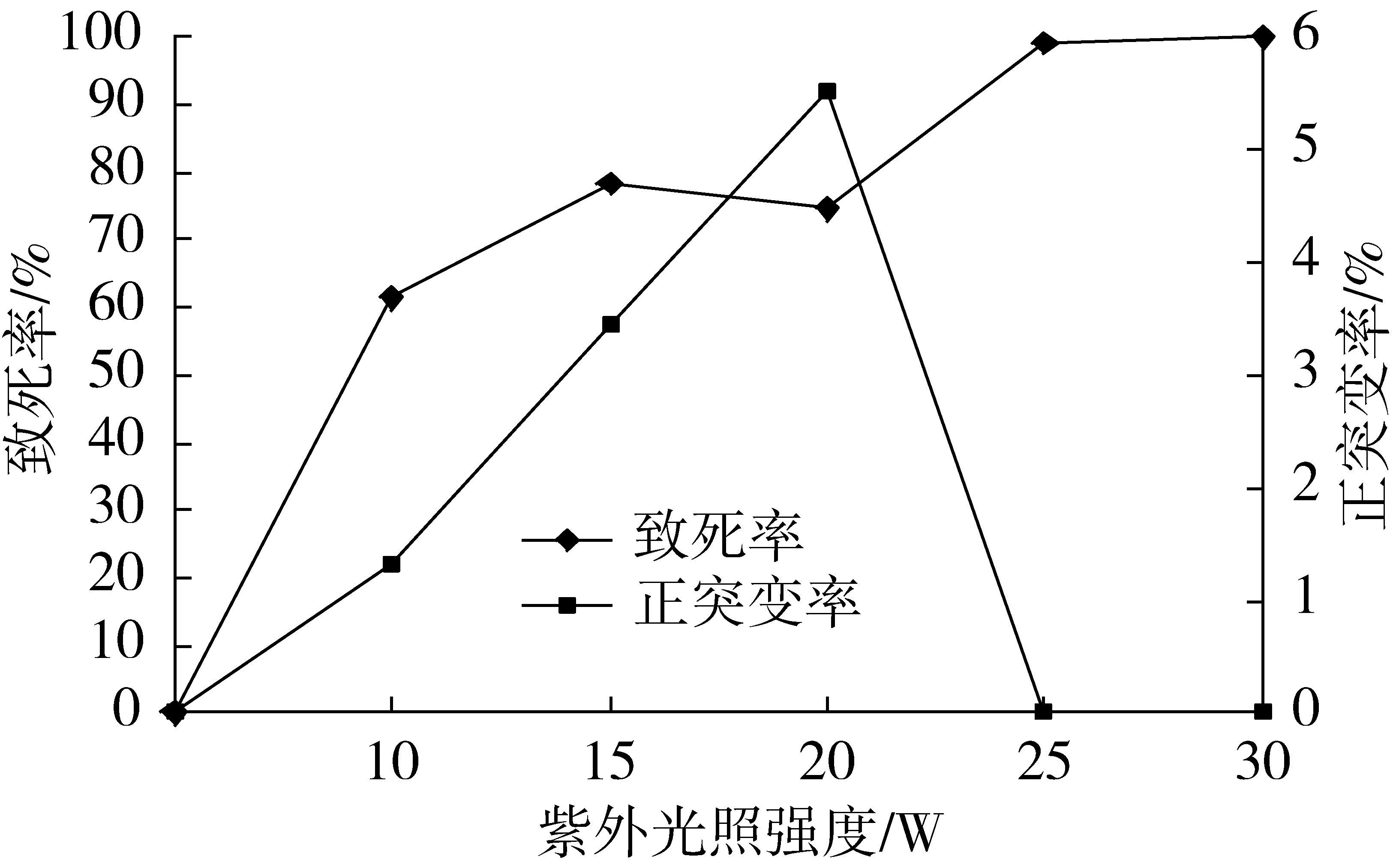
图2 不同UV辐照功率的诱变效果
2.2.2 诱变时间对诱变效果的影响
将配置好的菌悬液溶液分别置于紫外灯下照射0、2、4、6、8、10、12、14、16 min,辐照强度20 W,辐照距离9 cm,辐照后进行平板涂布和发酵培养,计算致死率和正突变率,结果见图3。
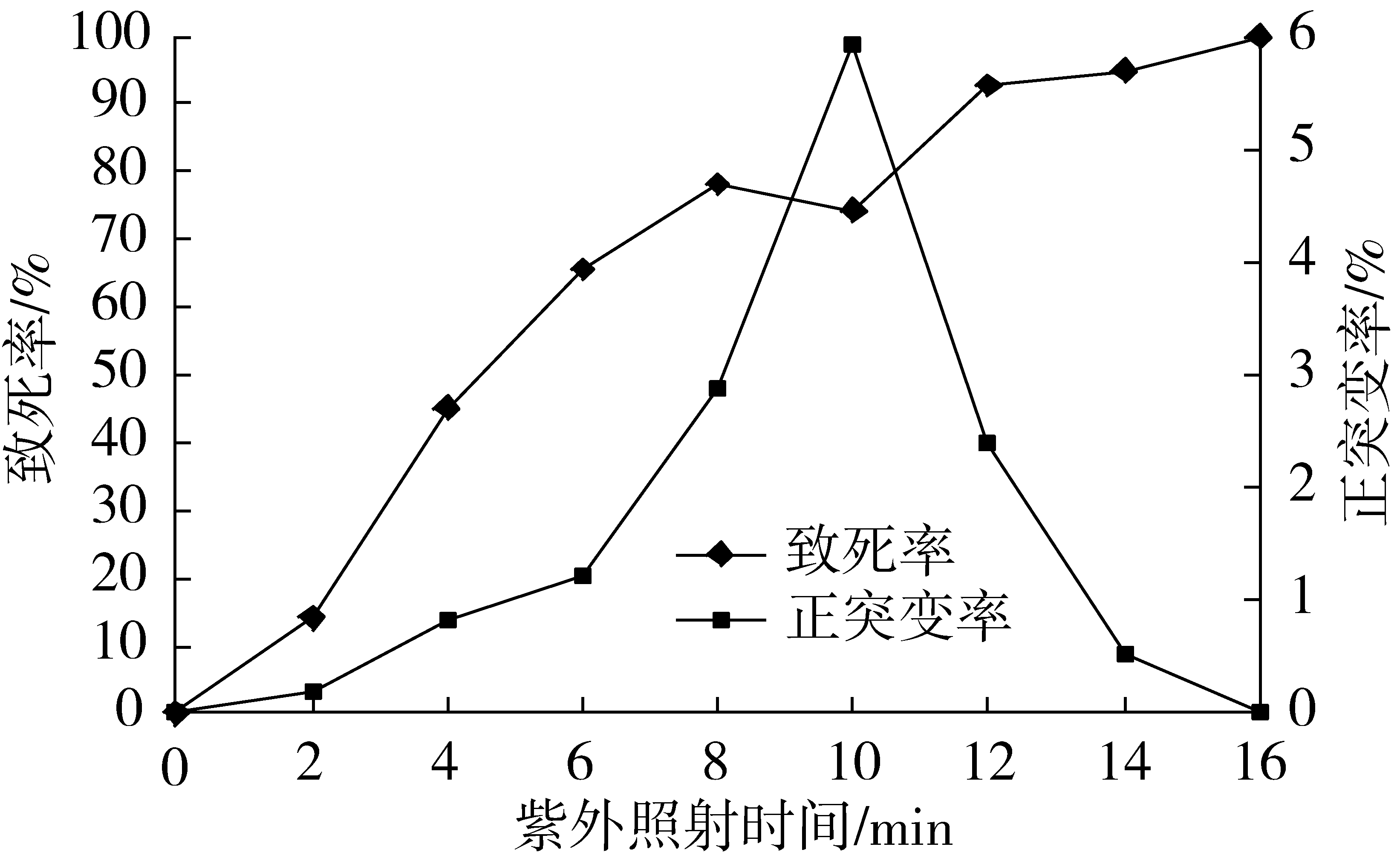
图3 不同UV辐照时间的诱变效果
如图3所示,不同UV辐照时间下的酵母菌致死率曲线为典型的马鞍型曲线。致死率随辐照时间的延长呈先上升后下降再上升的趋势,紫外辐照时间为10 min时致死率曲线取到极小值;正突变曲线随辐照时间的延长呈先上升后下降的趋势,在紫外辐照时间为10 min时正突变曲线取到最大值,因此诱变的最佳辐照时间初步选择10 min。
2.2.3 诱变距离对诱变效果的影响
将配置好的菌悬液溶液分别置于紫外灯下照射,调整辐照距离分别为21、18、15、12、9、6、3、0 cm,辐照强度20 W,辐照时间10 min,辐照后进行平板涂布和发酵培养,计算致死率和正突变率,结果见图4。
图4表明,不同UV辐照距离下的酵母菌致死率曲线为典型的马鞍型曲线。致死率随辐照距离的减小呈先上升后下降再上升的趋势,紫外辐照距离为9 cm时致死率曲线取到极小值;正突变曲线随辐照距离的减小呈先上升后下降的趋势,在紫外辐照距离为9 cm时正突变曲线取到最大值,因此诱变的最佳辐照距离初步选择9 cm。

图4 不同UV辐照距离的诱变效果
2.2.4 诱变条件的正交实验
表1为诱变条件的正交实验结果,对各条件下的正突变率进行极差分析,结果表明,致死率最高的组合为A3B3C3,即辐照功率为25 W,辐照距离为6 cm,辐照时间为12 min,此条件下紫外线对酵母菌诱变的致死率最高。由于正交实验方案中致死率最高的第7组组合A3B1C3,与极差得到的最优水平组合A3B3C3不符,对A3B1C3和A3B3C3分别进行3次验证实验,得到的酵母菌致死率的平均值分别为92.83%和93.52%,确定最优组合为A3B3C3。因RC>RA>RB,所以影响大小顺序为C>A>B,也就是辐照距离对紫外线诱变酵母菌的致死率影响最显著,其次是辐照功率,辐照时间对紫外线诱变酵母菌的致死率影响最小。由于致死率在70%~90%范围内诱变的正突变效果最好,因此致死率最高的紫外诱变条件不能代表诱变的最佳条件,需要通过正突变率的高低进行验证分析。
表1 紫外诱变条件优化L9(33)正交实验
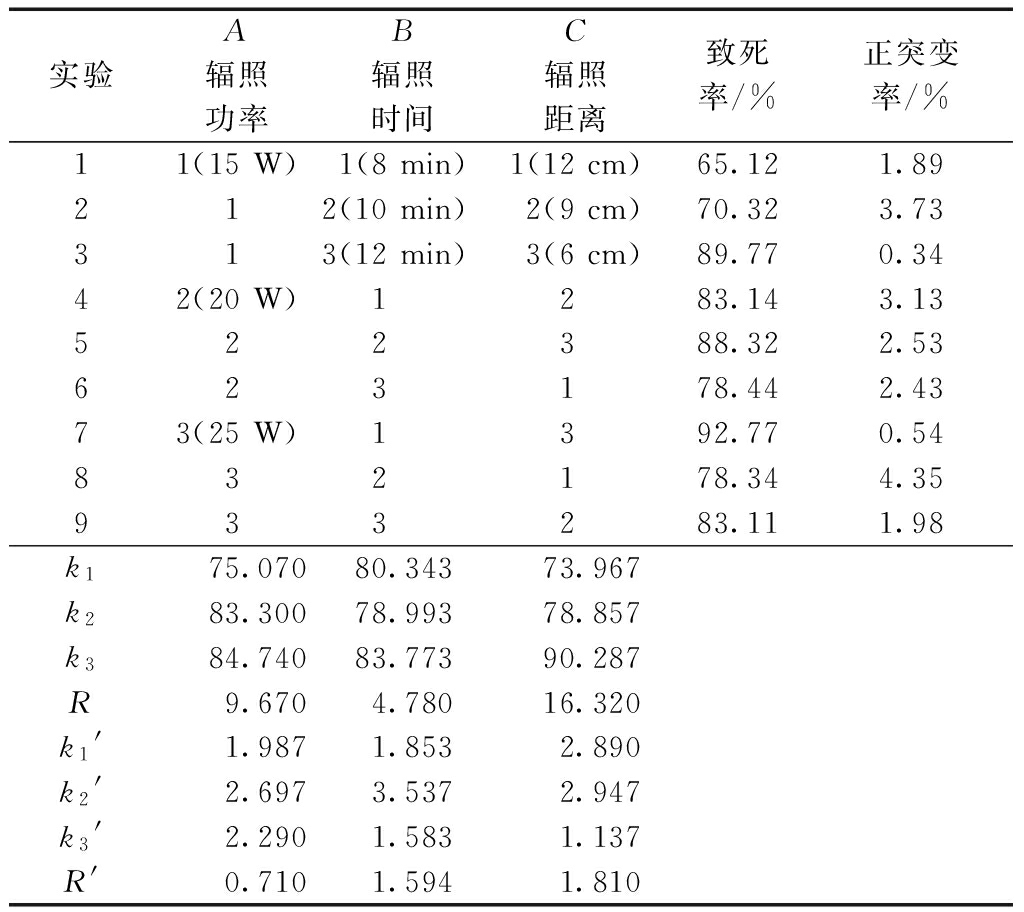
注:ki、R对应致死率,ki′、R′对应正突变率,i=1、2、3。
比较表1中k′值大小得出,根据正突变率最高的组合为A2B2C2,即辐照功率为20 W,辐照时间为10 min,辐照距离为9 cm,此条件下紫外线对酵母菌诱变的正突变率最高。由于正交实验方案中正突变率最高的第8组组合A3B2C1,与极差得到的最优水平组合A2B2C2不符,对A3B2C1和A2B2C2分别进行3次验证实验,得到的酵母菌正突变率的平均值分别为4.48%和5.04%,确定最优组合为A2B2C2。因RC′>RB′>RA′,所以影响大小顺序为C>B>A,也就是辐照距离对紫外线诱变酵母菌的正突变率影响最显著,其次是辐照时间,辐照功率对紫外线诱变酵母菌的正突变率影响最小。
2.3 酿酒酵母突变菌株的筛选
在确定好的诱变条件下进行酿酒酵母的紫外诱变处理,经初步平板培养观察选出长势较好的50个菌株,每个菌株进行发酵性能测试,最终筛选得到7株发酵性能较好的菌株,命名为F2~F8,出发菌株为F1。
2.3.1 菌株发酵过程中CO2的变化
由图5可知,发酵过程中不同菌株产CO2的量不同,起酵的速度差异不大。与出发菌株F1相比,酵母菌F2~F8的产气性均高于出发菌株,这8株酵母菌产气能力由强到弱依次为F4>F6>F8>F7>F3>F5>F2>F1,其中F4菌株的优良性比较突出,具有较高的产气性,表明其对糖的代谢利用效果最好,厌氧条件下乙醇产生能力可能较强。

图5 CO2的产生量
2.3.2 发酵后残糖含量、酒精含量的测定
如图6所示,8株酵母菌发酵液中残糖含量从低到高依次为F4<F6<F3<F2<F8<F1<F5<F7,发酵液酒精度由高到低依次为F4>F6>F8>F7>F3>F5>F2>F1,7株突变菌株中菌株F4的糖消耗程度、酒精产量都较高,与2.3.1中发酵液中CO2的产量较高相对应,菌株F4发酵液酒精度为11.08%,与原始菌株F1相比,酒精产生能力提高了24.32%。
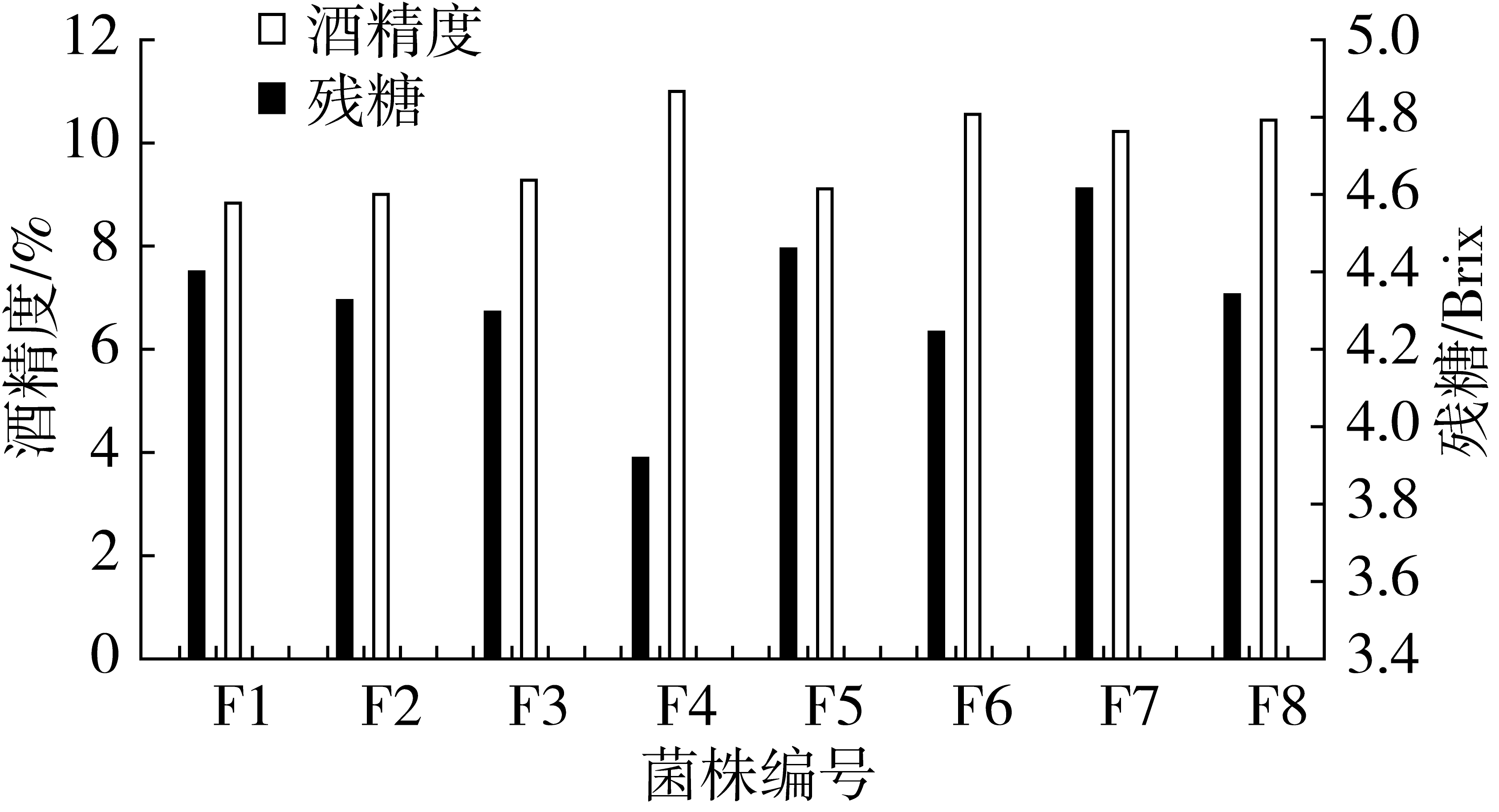
图6 终发酵液中残糖含量
如图7所示,菌株F4的糖醇转化率较高,其次是F6、F8、F7,而F3、F2、F5、F1的糖醇转化率较低,因此F4、F6在发酵糖类产生乙醇方面为优良菌株。
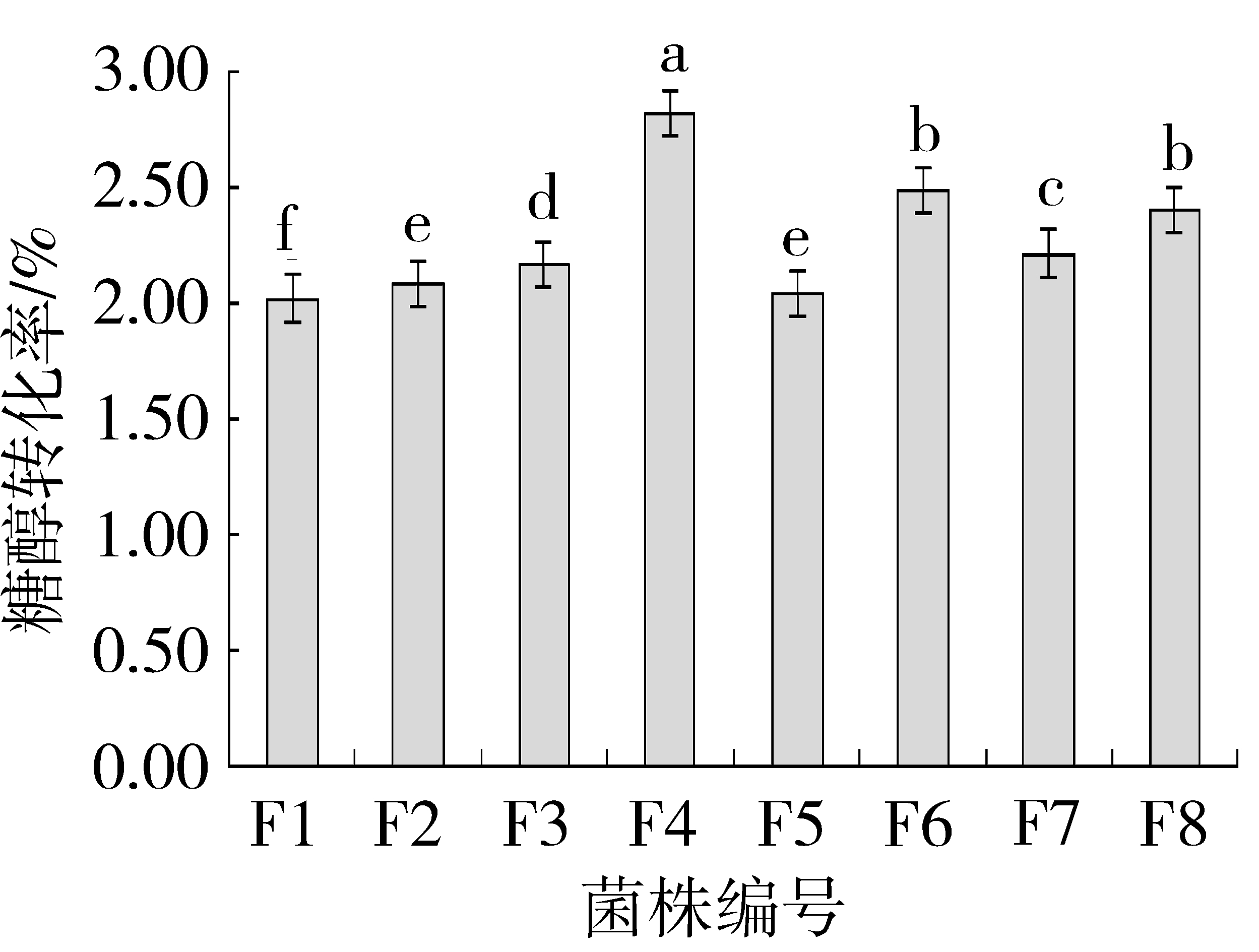
图7 各酵母菌菌株的糖醇转化率
2.3.3 发酵产酯能力实验
由图8可知,与出发菌株F1相比,诱变后得到的7株酵母菌菌株F2~F8的产酯能力都有不同程度的增加,诱变菌株F4发酵产酯能力最强,其次是F6和F7、F2和F3、F8、F5。其中酵母菌F4发酵液中酯类物质含量为0.67 g/L,与原始菌株F1相比产酯能力提高了0.09 g/L。
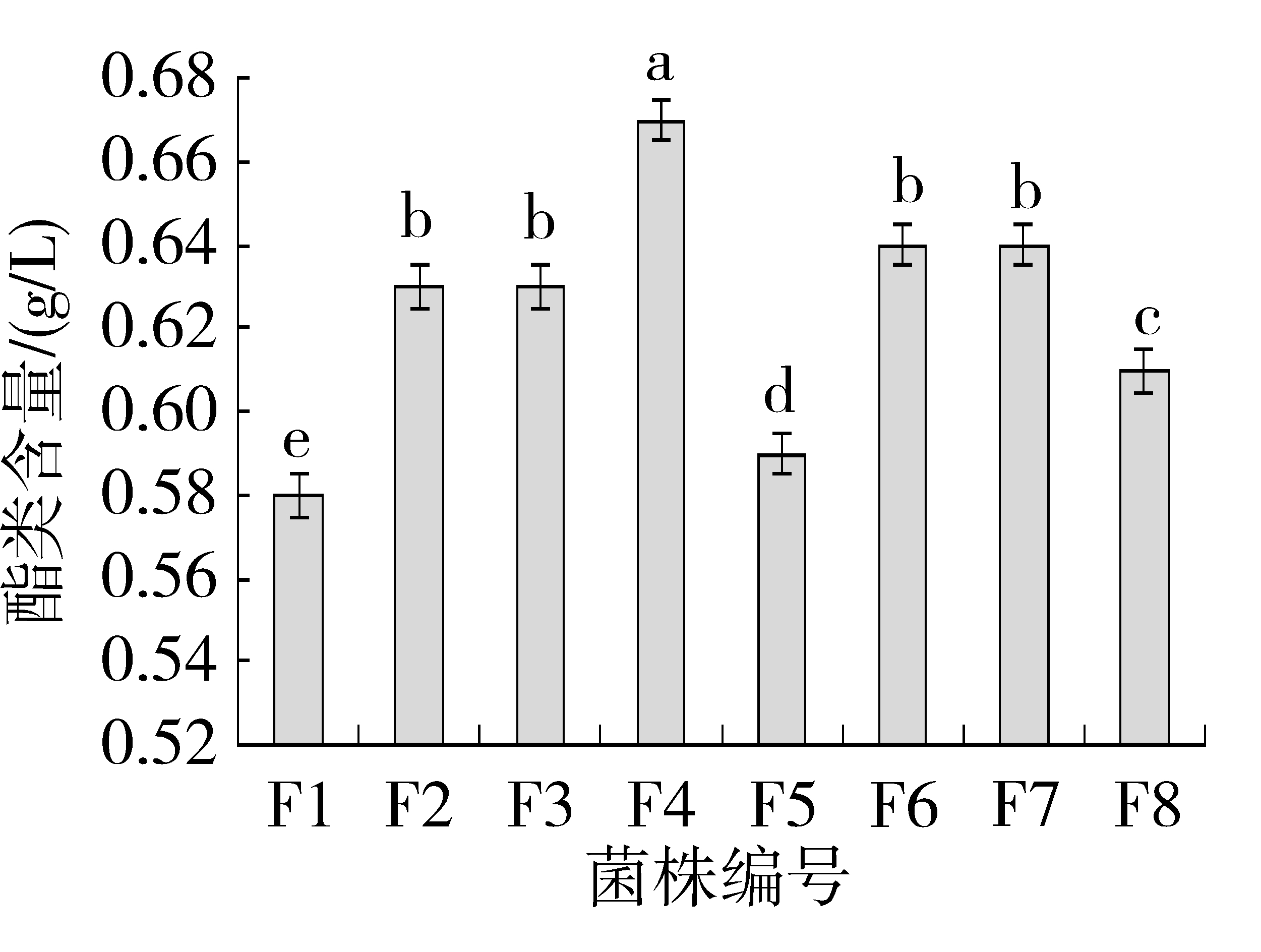
图8 终发酵液中酯含量
2.4 突变菌株F4形态特征
细胞特征:细胞饱满呈圆形、卵圆形,大小为(3.0~4.2)μm×(3.4~4.6)μm。
菌落特征:乳白色凸起、无纹状褶拆或疣状突起,边缘整齐平滑。
本实验中得到的致死率曲线为马鞍型曲线,与吴玉峰[14]等研究相符。马鞍型曲线是紫外线辐照对酵母菌损伤及其自身保护机制综合作用的结果。在马鞍型曲线中,致死率首先呈现增大趋势,说明紫外线对酵母菌会造成损害甚至死亡;致死率增大到一定程度呈减小趋势,可能是由于当损伤积累到一定程度时酵母菌机体能启动自身的修复机制[2];随后致死率不断增大直至100%,这可能是由于酵母菌的损伤过于严重,其修复机制的作用不足以修复这些损伤。
本研究中通过单因素及正交实验确定了紫外诱变条件,诱变辐照功率为20 W、诱变时间为10 min、距离为9 cm。通过对原始菌株和筛选得到的7个突变菌株的CO2产量、残糖含量、乙醇产量、糖醇转化率和酯的产量等实验分析,得到最佳突变菌株F4。酵母突变株F4细胞呈卵圆型,颜色为乳白色,发酵过程产气性好,CO2产量高,以紫甘薯汁为发酵原料,最高发酵酒精度为11.08%,总酯产量为0.67 g/L,保持有紫甘薯汁液的色泽;与原出发菌株F1相比,酒精发酵能力和产酯能力都有显著提高,酒精度提高24.32%,产酯能力提高了0.09 g/L。
参考文献:
[1]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005.
[2]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2010.
[3]李荣杰 微生物诱变育种方法研究进展[J].河北农业科学,2009,13(10):73-76,78.
[4]Watanabe T,Srichuwong S,Arakane M,et al.,Selection of stress-tolerant yeasts for simultaneous saccharification and fermentation(SSF)of very high gravity(VHG)potato mash to ethanol[J].Bioresour Technol.2010,101(24):9710-9714.
[5]Nielsen J,Pronk JT.Metabolic engineering,synthetic biology and systems biology[J].FEMS Yeast Res,2012,12(2):103-109.
[6]Wang P M.,Zheng D Q,Liu T Z,et al.The combination of glycerol metabolic engineering and drug resistance marker-aided genome shuffling to improve very-high-gravity fermentation performances of industrial Saccharomyces cerevisiae[J].Bioresour Technol,2012,108(2):203-210
[7]杨明琰,郭爱莲,沈俭,等.高产SOD酵母菌的诱变选育及发酵条件研究[J].食品科学,2005,26(10):147-150.
[8]Park B G,Lee W G,Chang Y K,et al.Long-term operation of continuous high cell density culture of Saccharomy cescerevisiae with membrane filtration and on-line cell concentration monitoring[J].Bioprocess Engineering,2011,21(2):97-100.
[9]Kim J W,Chin Y W,Park Y C,et al.Effects of deletion of glycerol-3-phosphate dehydrogenase and glutamate dehydrogenase genes on glycerol and ethanol metabolism in recombinant Saccharomyces cerevisiae[J].Bioprocess Biosyst Eng,2012,35(1-2):49-54.
[10]Nissen T L,Kielland-Brandt M C.Nielsen J.Anaerobic and aerobic batch cultivations of Saccharomyces cerevisiae mutants impaired in glycerol synthesis[J].Yeast,2010,16(5):463-474.
[11]顾蕾,陆玲,袁生.红酵母原生质体制备及其紫外诱变育种的研究[J].食品工业科技,2004,25(4):60-65
[12]Zhu M,Li P,Gong X,et al.A comparison of the production of ethanol between simultaneous saccharification and fermentation and separate hydrolysis and fermentation using unpretreated cassava pulp and enzyme cocktail[J].Biosci Biotechnol Biochem.2012,76(4):671-678.
[13]唐琳,范风玲,王涛.紫甘薯米酒生产工艺的研究[J].食品研究与开发,2007,28(2):101-104.
[14]吴玉峰,郑裕国,沈寅初.2,2-二甲基环丙腈水合酶产生菌的氮离子注入选育及突变株产酶条件研究[J].高校化学工程学报,2007,21(6):971-976.
[15]李兰松,杨利擎,刘旭光,等.低温等离子体对镍吸附细菌B8的诱变[J].高校化学工程学报,2013,27(3):462-469.●![]()
FANG Pei-Pei,WANG Shi-Qing,LI-Jing,TAN Hai-Gang,LIU Xiao-Li,FU Jun-Peng
(College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,China)
Abstract:Saccharomyces cerevisiae induced by UV mutagenesis to breeding the strains of high fermentation rate and alcohol production are investigated.Regarded fatality rate and percentage of plus mutants as main criterion,ethanol fermentation performance of mutant as reference,the proper condition of UV mutagenesis experimented by single factor and orthogonal experiment are as follows:UV radiation time for 10 min by ultraviolet lamp of 20w,distance from the lamp to sample at 9cm.And with the original strain F1 as control,physiological comprehensive performance tests of the seven mutant stains are conducted.The results are shown that an excellent positive mutated S.cerevisiae F4 is obtained,which has a high loss of carbon dioxide weight,low amount of residual sugar,superior production of ethanol and esters.The cell of this mutated strain F4 is full,its shape is oval,and its color is ivory-white or cream.It could be applied in the wine of purple sweet potato,of which the fermentation rate and alcohol production are high,the alcohol degree of fermentation broth can reach at 11.08%,the aroma is strong.So the potential industrial production of this mutated strain is well.
Key words:ultraviet mutation;yeast;breeding;purple sweet potato wine;
收稿日期:2015-07-15
基金项目:国家自然科学基金资助项目(31271963)
作者简介:方佩佩,1990年出生,女,硕士研究生.
通讯作者:王世清,1963年出生,男,教授.
中图分类号:TS201.3
文献标识码:A
文章编号:1007-7561(2016)01-0086-05