 2H2O)、二甲苯均为分析纯;水为去离子水经石英亚沸高纯水蒸馏器处理的重蒸水。
2H2O)、二甲苯均为分析纯;水为去离子水经石英亚沸高纯水蒸馏器处理的重蒸水。高向阳1,3,高遒竹2,张小燕1,王风云3
(1.郑州科技学院食品科学与工程学院,河南 郑州 450064;2.江南大学食品学院,江苏 无锡 214122;3.河南农业大学,河南 郑州 450002)
摘 要:为了建立一种快速、简便测定花生中氟含量及其分布的新方法,以花生为样品,利用超声波辅助浸提技术,用氟离子选择性电极浓度直读法测定。结果表明:氟电极的转化系数为90.53%,5次平行测定的相对标准偏差RSD<4.1%,加标回收率为91.6%~101.0%。氟在花生中分布由外到内依次减少。信阳市花生仁氟含量最低,为0.52 μg/g。该方法2 h之内即可完成,具有快速,方便,实用性强,对环境污染较小等优点,适合现场批量快速测定。
关键词:超声波浸提;浓度直读法;快速测定;氟分布;花生
适量氟可预防龋齿和骨质疏松,加速伤口愈合,促进人体对铁元素的吸收[1],成年人平均每天氟适宜的安全吸收量为0.5~1.7 mg[2],摄入过多就会引起恶心、呕吐、腹泻、肾功能损伤[3]。长期日摄入氟量超过容易导致氟斑牙、氟骨症和骨质变脆等症状。轻度氟中毒可引起腹痛、流泪、肺部不适、心功能不全;严重时可导致惊厥、麻痹甚至晕厥,严重影响人体健康[4]。
花生是食用坚果类食品,全身是宝。花生仁含有儿茶素等对人体起抗老化作用的活性物质,所含卵磷脂和脑磷脂可增强大脑记忆力[5];花生红衣对骨髓制造血小板有一定促进功能,并具有抗氧化[6]、抗过敏[7]、降血脂、降血糖、治疗出血和贫血等作用[8]。
目前,测定食品中的氟主要有离子色谱法[9]、催化荧光法[10]和国标法[11],离子色谱法和荧光法需要大型贵重仪器,成本高且不便于现场快速测定;国标法中的比色法需要专用试剂,测定过程费时费力;选择性电极法需要在半对数坐标纸上绘制标准曲线,麻烦费时,也不适合现场快速分析。浓度直读法具有仪器带携方便、操作简便、读数直观、计算简单、测定快速、成本低廉的优点,在食品科学中得到应用[12]。食品中氟的含量是食品安全领域必测的参数,但氟在花生不同组织中的分布鲜见文献报道。本实验用超声波辅助快速浸提,用浓度直读法测定花生不同组织中氟的含量及分布,为花生的开发利用提供科学参考。
1.1 主要试验材料
花生1号样品、花生2号样品分别于采自河南省邓州市和信阳市,外观完整、颜色正常,无破损和霉变现象。
1.2 主要仪器与设备
KQ520DE型数控超声波清洗器:昆山市超声仪器有限公司;PXSJ-216 型离子分析仪、甘汞参比电极、温度传感器、玻璃电极、氟离子选择性电极:上海仪电科学仪器股份有限公司;S Y Z-135 型石英亚沸高纯水蒸馏器:金坛市杰瑞尔电器有限公司;DZF-6050A型真空干燥箱:北京中兴伟业仪器有限公司;XT-9700型冷却机:新拓分析仪器科技有限公司。
1.3 主要试剂
100 m g/L氟离子标准贮备液配制:准确称取130 ℃烘至恒重的 NaF 0.110 5 g于无氟聚乙烯烧杯中,用少量高纯水溶解后定量移入500 mL容量瓶中定容,混匀后置于无氟塑料瓶中,于4 ℃冰箱中保存。
10.0 mg/L氟离子标准使用液配制:吸取100 mg/L 氟离子标准贮备液10.00 mL于100 mL容量瓶中,加高纯水定容,摇匀。逐级稀释为 1.00 mg/L 氟离子标准使用液。
总离子强度缓冲调节剂(TISAB)配制:量取700 mL水于2 L烧杯中,加入57.00 mL冰乙酸、58.00 gNaCl和12.00 g柠檬酸钠,溶解后加200 mL水,用5 mol/L NaOH溶液调节pH5.50,存于无氟塑料瓶瓶中备用。
饱和二甲苯溶液制备:取二甲苯于分液漏斗中,加少量水振荡,分去水层,进行蒸馏,收集馏出液备用(弃去前10 mL馏出液)。
氟离子标定液配制:吸取1.00 mg/L氟标准使用液2.00 mL于50 mL无氟聚乙烯烧杯中,加入25.00 mL TISAB、5.00 mL1.0mol/L HCl溶液、18.00 mL高纯水,混匀,配成含氟40.00 μg/L的A标定液。取1.00 mg/L氟标准使用液20.00 mL于50mL塑料烧杯中,加入25.00 mL TISAB、5.00 mL 1.0 mol/L HCl溶液,混匀,配成含氟400.00 μg/L的B标定液。移取25.00 mL TISAB溶液于50 mL无氟聚乙烯烧杯中,加入5.00 mL 1.0 mol/LHCI溶液,20.00 mL高纯水,混匀,为氟空白溶液。
氢氧化钠、浓盐酸、冰乙酸、氯化钠、氟化钠、二水柠檬酸钠(Na2C6H5O7 2H2O)、二甲苯均为分析纯;水为去离子水经石英亚沸高纯水蒸馏器处理的重蒸水。
2H2O)、二甲苯均为分析纯;水为去离子水经石英亚沸高纯水蒸馏器处理的重蒸水。
1.4 试验方法
1.4.1 样品预处理
样品分别用去离子水、高纯水各冲洗三次,除去表面灰尘和杂质,自然晾干,在干燥箱中60 ℃恒温干燥24 h。剥离花生外壳、红衣和仁。取各样品约300 g(花生红衣10 g)左右,用研钵研至全部过40目尼龙筛子后,分别置于聚乙烯塑料袋中保存,备用。
1.4.2 水分的测定
按GB 5009.3—2010《食品中水分的测定》第三法测定各样品中水分质量分数[13]。
准确称取适量试样放入250 mL蒸馏瓶中,加入饱和二甲苯浸没样品,连接冷凝管与水分接收管,从冷凝管顶端注入甲苯,装上水分接收管。加热慢慢蒸馏,使每秒钟的馏出液为2~4滴,当接收管内的水分体积不再增加时,从冷凝管顶端加入饱和二甲苯冲洗。至接收管上部及冷凝管壁无水滴附着,水分接收管水平面保持10 min不变即为蒸馏终点,读取接收管中水层的体积V,按(1)式计算样品中水分含量。
ω0=100V×0.998/m
(1)
式中:ω0为试样中水分质量百分数,g/100 g;V为接收管内水的体积,mL;m为试样质量,g;0.998为室温时水的密度,g/mL。
1.5 样品测定
预热好PXSJ-216型离子分析仪,按“模式4”键,选择“直读浓度”模式,按“确认”键,选择质量浓度单位“μg/L”,按两次“确认”键,选择“二点校准”并按“确认”键,输入C1=40.00 μg/L,将温度传感器、参比电极及氟离子电极插入标定液A中,打开磁力搅拌器搅拌2 min左右,屏幕数字显示稳定后,按两次“确认”键,输入C2=400.00 μg/L,将清洗处理后的温度传感器、参比电极及氟离子电极插入标定液B中,继续搅拌2 min左右,数字显示稳定后,按两次“确认”键,测得电极实际斜率值,离子计显示进入测定状态。按“确认”键,进行“空白浓度”校准,将清洗后的温度传感器和电极对插入空白溶液中,搅拌2 min左右,数显显示稳定后,按“确认”键,得空白浓度值,按“确认”储存“空白值”,完成仪器标定。
准确称取花生壳、花生仁各2 g左右,花生红衣1 g左右(准至0.000 1 g)分别置于25 mL比色管中,加入2 mL高纯水、1 mL 5mol/L NaOH溶液[14]、2 mL 95%乙醇,65 ℃恒温加热90 min,不时振荡比色管至管内液体为均匀油状后,用冰水冷却,滴加0.5 mL 6 mol/L HCl溶液后,再加入5 mL 1mol/L HCl溶液,超声浸提6 min后,加入12.50 mL TISAB,加水稀至刻度,混匀后倒入无氟聚乙烯塑料杯中。插入清洗好的电极,轻轻摇匀后,直接从仪器上读取稳定的浓度值。按(2)式计算氟含量:
ω=ρ×25.00×10-3/m(1-ω0)
(2)
式中:ω为干基样品含氟的质量分数,μg/g;ρ为仪器读取试液的质量浓度,μg/L;m为样品的质量,g;ω0为样品含水质量百分数,g/100g。
2.1 水分测定结果
各样品水分含量按照1.4.2进行3次平行测定,取平均值,测定结果如表1所示。
表1 样品水分测定结果(n =3)

由表1可知,各花生组织样品水分含量因在同样条件下按1.4.1进行预处理,差异较小,平行测定的相对标准偏差RSD<0.4%。
2.2 乙醇的用量选择
用加碱皂化水解法进行脂肪处理,加入乙醇可大大缩短脂肪水解时间。试验表明,样品用量为1~2 g,在65 ℃下,乙醇用量大于2.00 mL时水解时间最短。试验采用加乙醇2.00 mL,水解时间90 min。
2.3 超声浸提时间确定
在额定功率200 W,工作频率40 kHz的条件下,样品在室温25 ℃环境下超声浸提时间与测定结果如表2所示。
表2 超声波浸提时间对测定结果的影响(n=5) μg/g
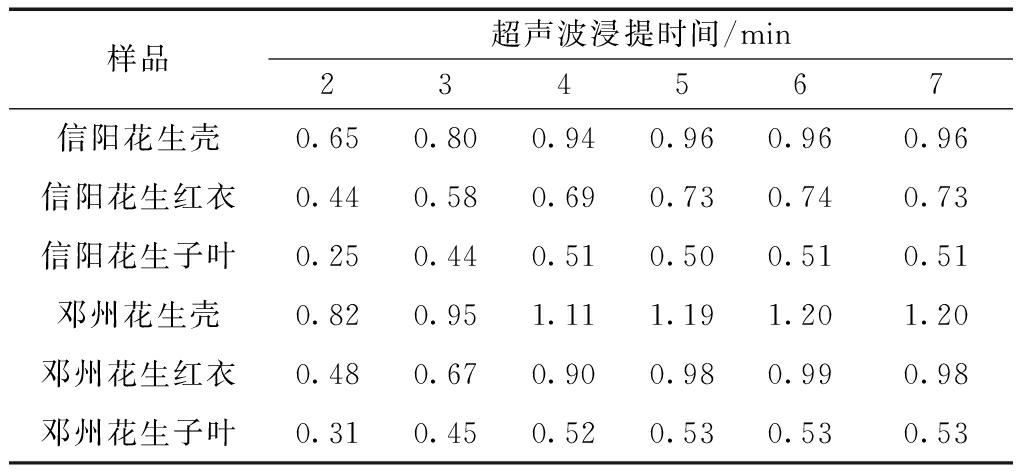
由表2可知,各样品5~7min即可达到浸提平衡,本试验超声浸提时间为6 min。
2.4 氟电极的转换系数
试验表明氟电极的实际斜率对测定结果有很大影响。试验测得实际斜率K=-53.555,氟离子电极的转换系数按照以下公式计算:
Kir/%=(实际斜率/理论斜率)×100%=(-53.555/-59.159)×100%=90.53%,说明氟离子电极的能斯特响应良好[15]。
2.5 样品测定结果
样品按1.5方法进行5次平行测定,检验无可疑值后,按(2)式计算,取平均值报告,结果如表3所示。
表3 样品组织中氟测定结果(n=5)

由表3可知,样品测定的RSD<4.1%,氟含量呈由外至里逐渐减少分布,信阳花生仁干基氟含量较低,为0.52 μg/g,邓州市花生壳氟含量较高,为1.20 μg/g。
2.6 样品氟加标回收率
准确称取各样品0.500 0 g,按1.5方法进行3次平行测定,按公式(2)计算,取平均值报告结果。分别准确加入0.50 mL 10.00 mg/L氟离子标准溶液,同理测出加标后的结果,按平均值计算回收率,结果如表4所示。
表4 氟回收率测定结果

由表4知,样品的氟加标回收率为91.6%~101.0%,结果令人满意。
超声波功率200 W,工作频率40 kHz,样品超声5~7 min即可达到浸提平衡。加入TISAB可消除铁、铝、硅、OH-、H+等离子对测定结果的影响。测定结果表明:氟在花生不同组织中的分布规律为从外到内依次减少,花生仁中氟的质量分数为0.5 μg/g左右。
超声波辅助盐酸浸提,氟离子选择性电极浓度直读法测定花生中的氟,不需要绘制曲线和进行复杂运算,离子计标定后即可进行测定,读数直观,操作方便,成本低廉,所用仪器质量只有1 kg左右,小巧便携,适合于现场快速测定。测定结果为花生的食用和精细加工提供科学参考,有一定的推广与应用价值。
参考文献:
[1]![]()
![]() S
S ![]() .Fluorine Content in Soits of Northern Pomoravlje[J].Journal of Agricultural Sciences,2012,47(2):121-128.
.Fluorine Content in Soits of Northern Pomoravlje[J].Journal of Agricultural Sciences,2012,47(2):121-128.
[2]中国营养协会.中国居民膳食营养素参考摄入量[M].北京:中国轻工业出版社,2006.
[3]高向阳,李彩丽.超声波浸提—加标浓度直读法快速测定大豆中的微量氟[J].食品科学,2009,30(18):300-302.
[4]李旭攻.茶叶中氟含量的研究及对人体健康的影响[J].中国茶叶加工,2004(1):35-38.
[5]赵志敏,张潇风.花生的保健功能及开发利用[J].中国食物与营养,2007(7):47-49.
[6]Constanza K E,White B L,Davis J P,et al.valueadded processing of peanut skins:antioxidant capacity,total phenolics,and procyanidin conten of spray-dried extracts[J].J Agric Food Chem,2012,60(43):10776-10783.
[7]Tsujita J,Shintani T,Sato H.Preparation and charactersation of peanut seed skin polyphenols[J].Food Chemistry,2014,151:15-20.
[8]张慧文,许海燕,马超美.花生红衣研究进展[J].花生学报,2015,44(1):1-7.
[9]曹磊,赵斌,周泳德,等.扩散-离子色谱法测定植物样中的氟[J].地质学报,2012,36(12):216-218.
[10]李志英,李林,张焱.罗丹明6G催化动力学荧光光度法测定水中氟化物[J].分析科学学报,2015,31(1):143-145.
[11]GB/T 5009.18—2003,食品中氟的测定[S].北京:中国标准出版社,2004:149-150.
[12]高向阳,宋莲军,乔明武,等.南阳彩色小麦微量氟的分布及浓度直读快速分析方法研究[J].食品科学,2005,26(11):187-189.
[13]GB 5009.3—2010,食品中水分的测定[S].北京:中国标准出版社,2010.
[14]耿娟,丁仕兵,郭兵,等.食品中氟化物的前处理及测定方法[J].食品安全导刊,2010(Z1):40-41.
[15]高向阳.新编仪器分析(第四版)[M].北京:科学出版社,2013,150-151.●![]()
GAO Xiang-yang1,3,GAO Qiu-zhu2,ZHANG Xiao-yan1,WANG Feng-yun3
(1.Institute of Food Science and Engineering,Zhengzhou Institute of Science and Technology,Zhengzhou Henan 450064;2.Food Science and Technology School,Jiangnan University,Wuxi Jiangsu 214122;3.Henan Agricultural University,Zhengzhou Henan,450002)
Abstract:In order to establish a rapid,simple and new analysis method for determination of fluorine content and its distribution in peanut.With peanut as the samples from Xinyang and dengzhou city respectively,The Determination of fluoride ion by selective electrode with direct reading concentration method,after samples were extracted with ultrasonic.The results show that Conversion factor of fluorine electrode was 90.53%,relative standard deviation RSD<4.1% based on the Samples parallel determination(n=5),and Standard addition recovery was 91.6%~101.0% between.The fluorine distribution is reduced from outside to inside in peanut.Xinyang dry base peanut fluorine content lowest is 0.52 μg/g.This method can complete within 2 h,At the same time with fast,convenient and practical,less environmental pollution,suitable for mass rapid determination.
Key words:ultrasonic extraction;concentration direct reading;rapid determination;fluorine distribution;peanut
收稿日期:2015-06-15
基金项目:郑州市科技局新兴产业研究与开发基金项目(153PXXCY186)
作者简介:高向阳,1949年出生,男,教授.
通讯作者:王风云,1972年出生,女,硕士,实验师.
中图分类号:TS 207.5
文献标识码:A
文章编号:1007-7561(2016)01-0064-04